몰(mole)은 화학에서 물질의 양을 나타내는 기본 단위로, 원자·분자·이온과 같은 미시적 입자를 거시적 세계에서 다룰 수 있게 해주는 핵심 개념이다. 1몰은 아보가드로 수(6.022×10²³)만큼의 입자를 포함하며, 이를 통해 질량·부피·입자 수 사이의 관계를 정량적으로 연결할 수 있다. 몰 개념은 화학 반응식에서 계수의 의미를 해석하고, 반응물과 생성물 사이의 몰 비율을 이용해 실제 반응량을 계산하는 데 필수적이다. 또한 몰 질량을 이용하면 질량에서 몰 수로, 몰 수에서 다시 질량이나 기체 부피로 변환할 수 있어 화학 계산의 중심 역할을 한다. 이러한 양적 계산은 제한 반응물 판별, 이론적 수율 계산, 용액 농도 산출, 기체 반응 해석 등 다양한 화학 문제 해결의 기반이 된다. 본 글에서는 몰의 정의, 아보가드로 수의 의미, 화학 반응에서의 몰 비율 적용 원리를 전문가적 관점에서 체계적으로 분석한다.
서론: 몰 개념은 화학 계산을 가능하게 만드는 핵심 언어다
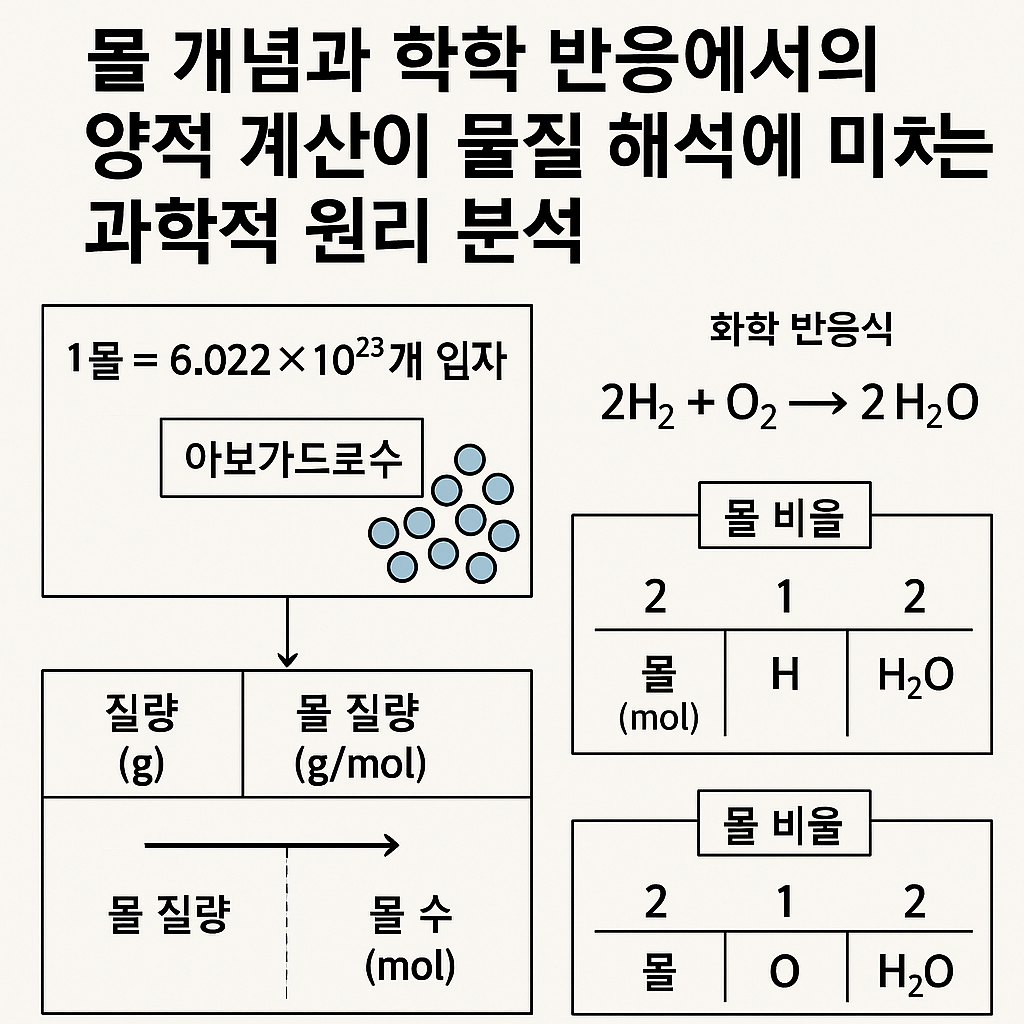
화학 반응은 원자와 분자의 재배열 과정이지만, 실제 실험과 산업 현장에서는 눈에 보이지 않는 입자의 개수를 직접 다룰 수 없다. 이러한 문제를 해결하기 위해 도입된 개념이 바로 몰이다. 몰은 미시적 입자의 세계와 거시적 질량 세계를 연결하는 다리 역할을 하며, 화학 계산의 공통 언어로 사용된다. 예를 들어 탄소 원자 6.022×10²³개를 한 묶음으로 정의하면, 그 질량은 약 12g이 된다. 이처럼 몰 개념을 이용하면 입자 수를 직접 세지 않고도 물질의 양을 정확히 비교하고 계산할 수 있다. 몰 개념은 단순한 단위 정의를 넘어 화학 반응 해석의 핵심 도구다. 반응식의 계수는 질량 비율이 아니라 몰 비율을 의미하며, 이를 정확히 이해하지 못하면 화학 계산 전반에서 오류가 발생한다. 따라서 몰 개념을 제대로 이해하는 것은 화학 학습의 출발점이라 할 수 있다.
본론: 몰 질량·아보가드로 수·반응식의 몰 비율 적용
몰의 정의에서 가장 중요한 요소는 아보가드로 수다. 아보가드로 수는 1몰에 포함된 입자의 수를 의미하며, 이는 모든 물질에 동일하게 적용된다. 즉, 1몰의 물은 1몰의 이산화탄소와 입자 수는 같지만 질량은 다르다. 이러한 차이는 각 물질이 가지는 몰 질량에 의해 설명된다. 몰 질량은 해당 물질을 구성하는 원자량의 합으로 계산되며, g/mol 단위를 가진다. 화학 반응식에서 계수는 반응물과 생성물 사이의 몰 비율을 나타낸다. 예를 들어 2H₂ + O₂ → 2H₂O 반응식은 수소 2몰이 산소 1몰과 반응해 물 2몰을 생성함을 의미한다. 이를 통해 반응물의 질량이 주어졌을 때 생성물의 질량을 계산할 수 있다. 이 과정에서 제한 반응물 개념이 등장하는데, 이는 먼저 소모되는 반응물을 의미하며 전체 반응량을 결정하는 핵심 요소다. 또한 몰 개념은 기체 반응에서도 중요하다. 동일한 온도와 압력 조건에서 1몰의 기체는 항상 동일한 부피를 차지하며, 이는 아보가드로 법칙에 기반한다. 이를 통해 기체 반응에서 부피 비율을 몰 비율로 직접 해석할 수 있다. 용액 화학에서도 몰 농도(M)는 용액 1L당 용질의 몰 수로 정의되어, 반응 계산과 농도 조절의 기준이 된다.
결론: 몰 개념은 화학적 사고와 정량 분석의 핵심 기반이다
몰 개념은 화학 반응을 수식과 계산으로 다룰 수 있게 해주는 핵심 도구다. 이를 통해 입자 수, 질량, 부피, 농도 사이의 관계를 정량적으로 연결할 수 있으며, 복잡한 화학 반응도 체계적으로 분석할 수 있다. 반응식의 계수를 몰 비율로 이해하는 순간, 화학 계산은 단순 암기가 아닌 논리적 사고의 영역으로 확장된다. 앞으로의 화학 학습과 산업 응용에서도 몰 개념은 중심적인 역할을 계속 수행할 것이다. 신소재 개발, 의약품 제조, 환경 분석, 에너지 공정 등 다양한 분야에서 정확한 양적 계산은 필수적이며, 그 출발점에는 항상 몰 개념이 존재한다.