물질은 온도와 압력 조건에 따라 고체·액체·기체의 서로 다른 상태로 존재하며, 이러한 변화는 상태 변화와 상평형 개념으로 설명된다. 고체에서 액체로의 융해, 액체에서 기체로의 기화, 기체에서 액체로의 응축, 고체에서 기체로의 승화 등은 모두 분자 운동 에너지와 분자 간 인력의 균형 변화에 의해 발생한다. 상태 변화 과정에서는 물질의 온도가 일정하게 유지되며, 외부에서 공급되거나 방출되는 에너지는 결합을 끊거나 형성하는 데 사용된다. 상평형은 서로 다른 상이 동시에 공존하는 조건을 의미하며, 이는 상평형도(phase diagram)를 통해 시각적으로 표현된다. 상평형도에서는 삼중점과 임계점과 같은 중요한 개념이 등장하며, 이 지점들은 물질의 상태 거동을 이해하는 핵심 기준이 된다. 상태 변화와 상평형 개념은 자연 현상 해석뿐 아니라 냉각·가열 공정, 기상학, 재료 공학, 화학 공정 설계 등 다양한 분야에서 필수적인 과학적 기반을 제공한다. 본 글에서는 상태 변화의 에너지 관점, 상평형의 의미, 상평형도의 구조를 전문가적 시각에서 체계적으로 분석한다.
서론: 상태 변화는 분자 운동과 에너지 분포의 결과다
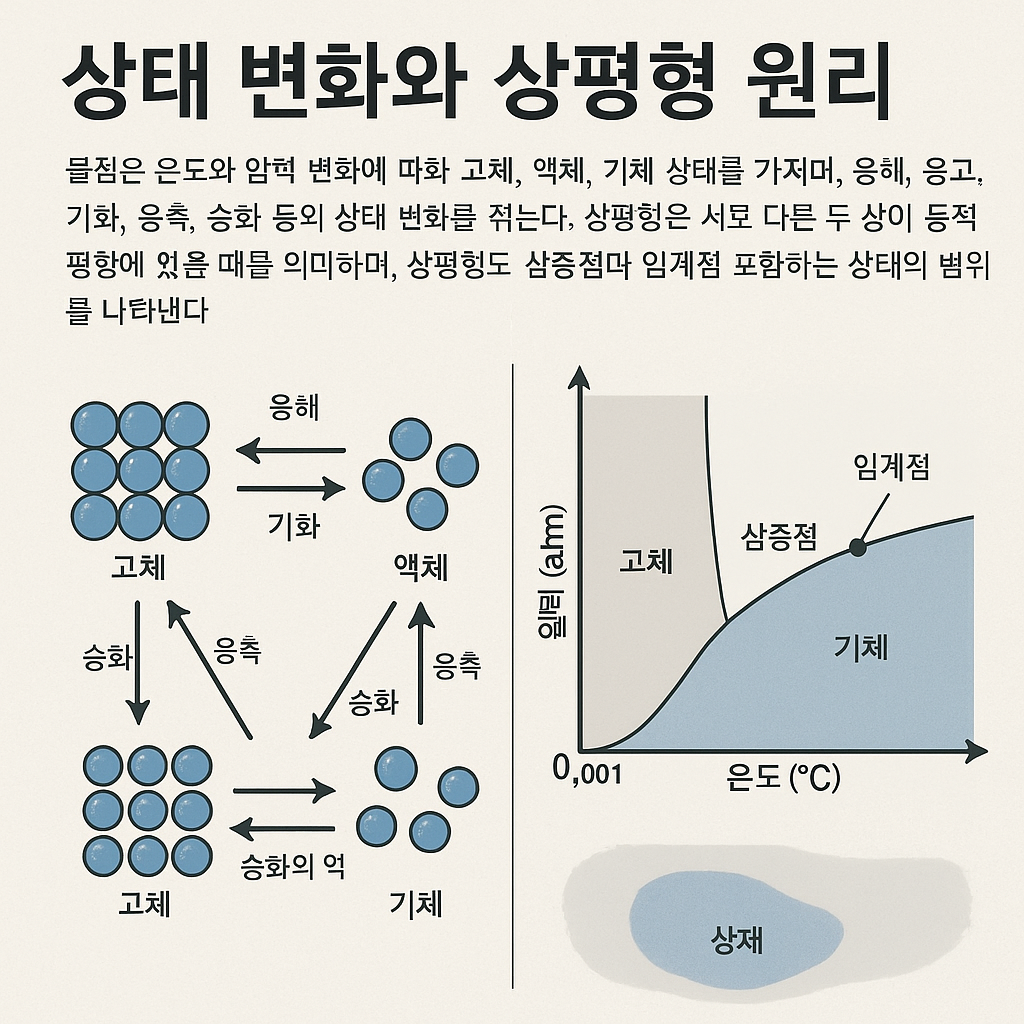
물질은 외부 조건에 따라 고체, 액체, 기체라는 서로 다른 상태로 존재한다. 이러한 상태의 차이는 분자 간 거리, 배열, 운동 방식의 차이에서 비롯된다. 고체에서는 분자들이 규칙적인 배열을 이루며 진동 운동만 하고, 액체에서는 분자들이 비교적 자유롭게 이동하지만 여전히 인력이 유지된다. 기체에서는 분자 간 인력이 매우 약해져 분자들이 자유롭게 공간을 이동한다. 상태 변화는 이러한 분자 운동 상태가 전이되는 과정으로, 단순한 온도 변화가 아니라 에너지의 분배 방식이 달라지는 현상이다. 예를 들어 얼음이 녹을 때 온도는 0°C로 일정하지만, 외부에서 공급된 에너지는 분자 간 결합을 끊는 데 사용된다. 이러한 잠열 개념은 상태 변화를 이해하는 데 핵심적인 요소다. 상태 변화는 일상적인 현상부터 산업 공정에 이르기까지 매우 광범위하게 나타난다.
본론: 상태 변화의 에너지 구조와 상평형도의 과학적 의미
상태 변화는 크게 융해(고→액), 응고(액→고), 기화(액→기), 응축(기→액), 승화(고→기), 승화의 역과정으로 구분된다. 이러한 변화는 분자 운동 에너지와 분자 간 인력 사이의 균형 변화로 설명된다. 기화 과정에서는 분자들이 충분한 에너지를 얻어 인력을 극복하고 기체 상태로 전이하며, 응축 과정에서는 에너지를 잃어 다시 인력이 우세해진다. 상평형은 두 개 이상의 상이 동시에 존재하면서 서로 전환되는 속도가 같아진 상태를 의미한다. 예를 들어 물과 수증기가 동시에 존재하는 상황에서는 기화와 응축이 같은 속도로 일어나며, 이를 동적 평형이라 한다. 이러한 평형 상태는 온도와 압력에 따라 달라진다. 상평형도는 물질의 상태를 온도와 압력의 함수로 나타낸 그래프로, 각 영역은 고체·액체·기체 상태를 의미한다. 상평형도에서 **삼중점**은 세 가지 상이 동시에 공존하는 유일한 조건이며, **임계점**은 액체와 기체의 구분이 사라지는 지점이다. 물의 경우 삼중점은 0.01°C, 0.006atm 부근에 존재하며, 임계점 이후에는 초임계 유체 상태가 된다. 이러한 개념은 냉장·냉동 기술, 초임계 추출, 기상 변화 예측, 재료 합성 공정 등 다양한 분야에서 실질적으로 활용된다.
결론: 상태 변화와 상평형은 물질 거동을 예측하는 핵심 과학 개념이다
상태 변화와 상평형 개념은 물질이 외부 조건에 어떻게 반응하는지를 이해하는 데 필수적인 과학적 도구다. 상태 변화는 에너지의 전달 방식과 분자 간 인력의 변화를 반영하며, 상평형은 서로 다른 상이 공존할 수 있는 조건을 명확히 보여준다. 특히 상평형도는 물질의 상태를 한눈에 파악할 수 있게 해주는 매우 중요한 시각적 도구다. 이러한 원리는 자연 현상 설명을 넘어 산업 공정 설계, 에너지 기술, 환경 제어, 재료 과학 등 다양한 분야에서 핵심적 역할을 한다. 앞으로도 상태 변화와 상평형에 대한 이해는 효율적인 에너지 활용과 신기술 개발의 중요한 기반으로 계속 활용될 것이다.