용액의 농도는 일정한 양의 용매 또는 용액 속에 얼마나 많은 양의 용질이 녹아 있는지를 나타내는 지표로, 화학 실험과 산업 공정 전반에서 핵심적인 역할을 한다. 농도 표현 방식에는 몰농도, 몰랄농도, 질량 백분율, 부피 백분율, ppm 등 다양한 방법이 있으며, 각 방식은 사용 목적과 조건에 따라 선택된다. 정확한 농도 표현과 계산은 반응의 수율 예측, 반응 속도 해석, 정량 분석, 품질 관리에 직접적인 영향을 미친다. 특히 몰농도는 화학 반응식과 직접 연결되어 반응물과 생성물의 양적 관계를 계산하는 데 가장 널리 활용된다. 농도 계산은 단순한 수치 연산이 아니라, 물질의 양과 부피 개념을 종합적으로 이해해야 가능한 과정이다. 본 글에서는 주요 농도 표현 방법의 정의와 특징, 상황별 활용 기준, 농도 계산이 가지는 과학적 의미를 전문가적 관점에서 체계적으로 분석한다.
서론: 농도는 용액을 이해하는 가장 기본적인 언어다
화학 실험에서 용액을 다룰 때 가장 먼저 확인해야 하는 정보는 농도다. 같은 물질이라도 농도가 달라지면 반응의 진행 속도와 결과는 완전히 달라질 수 있다. 따라서 농도는 용액의 성질을 규정하는 가장 기본적인 지표라 할 수 있다. 농도는 단순히 “진하다” 또는 “묽다”라는 감각적 표현을 수치화한 개념이다. 이를 통해 화학자는 서로 다른 실험 조건을 비교하고, 반응을 정량적으로 분석할 수 있다. 농도 개념을 정확히 이해하는 것은 화학 계산과 실험 설계의 출발점이다.
본론: 주요 농도 표현 방법과 계산 원리
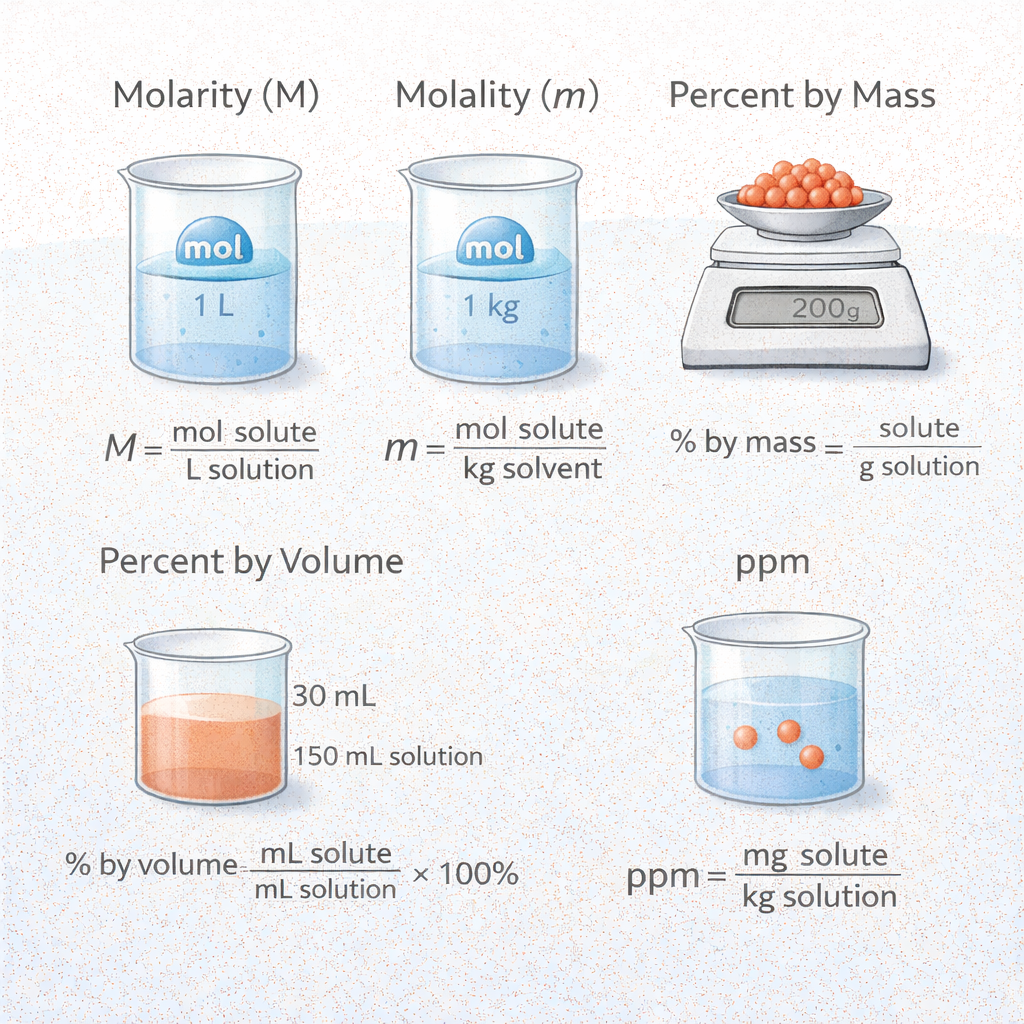
가장 널리 사용되는 농도 표현 방식은 몰농도(M)다. 몰농도는 용액 1리터에 녹아 있는 용질의 몰 수로 정의되며, 화학 반응식과 직접적으로 연결된다. 반응물의 몰 비를 계산할 때 몰농도는 가장 직관적이고 효율적인 단위다. 몰랄농도(m)는 용매 1킬로그램당 용질의 몰 수로 정의되며, 온도 변화에 영향을 받지 않는다는 장점이 있다. 따라서 열역학적 계산이나 끓는점 오름, 어는점 내림과 같은 성질을 분석할 때 유리하다. 질량 백분율과 부피 백분율은 혼합물의 조성을 직관적으로 표현할 수 있어 산업 현장과 일상생활에서 자주 사용된다. ppm은 매우 낮은 농도를 표현할 때 사용되며, 환경 분석이나 수질 검사에서 필수적인 단위다. 농도 계산은 단순한 공식 암기가 아니라, 용질의 몰 수, 질량, 부피 사이의 관계를 정확히 이해해야 가능하다. 특히 희석 계산에서는 물질의 몰 수가 변하지 않는다는 원리를 적용해 논리적으로 접근해야 한다.
결론: 농도 계산 능력은 화학적 사고의 핵심이다
용액의 농도 표현과 계산은 화학 실험과 분석에서 가장 기본적이면서도 중요한 기술이다. 농도를 정확히 이해하고 계산할 수 있어야 반응 조건을 제어하고, 실험 결과를 신뢰할 수 있다. 농도 개념은 화학을 수치와 논리의 학문으로 만들어 주는 핵심 요소다. 다양한 농도 표현 방식을 상황에 맞게 선택하고 활용할 수 있을 때, 화학 현상에 대한 이해는 한층 더 정교해진다. 이는 화학을 넘어 환경 과학, 생명 과학, 공학 분야에서도 필수적인 과학적 역량으로 작용한다.